Le point sur la DMLA Atrophique
A ce jour, les traitements de la DMLA atrophique sont décevants.
Les produits testés ont montré peu ou pas d’effets, ou des effets secondaires insupportables (héméralopie invalidante).
Adnan Tufail est revenu sur l’étude du Lampilazumab. Il s’agit d’un anticorps inhibant le facteur D du complément. Le Lampalizumab était administré à la dose de 10 mg en q4 où en q8. Les résultats n’ont pas atteint la significativité, et la molécule est abandonnée, mais l’étude des groupes de l’étude est en cours pour essayer de mieux comprendre la physiopathologie de la DMLA atrophique.
On peut se poser plusieurs questions :
Est-ce que les études ont bien inclus de véritables DMLA atrophiques et non des maladies semblables, voire des formes frontières ?
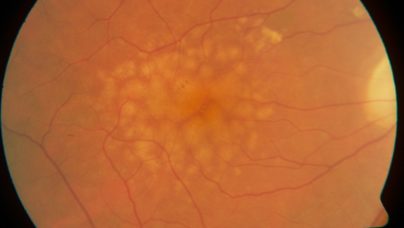
Une zone d’atrophie doit avoir des limites nettes, avec effet fenêtre qui permet la visualisation des vaisseaux choroïdiens.
Quelle imagerie ?
- L’atrophie est suspectée sur les rétinophotographies couleur,
- Confirmée sur les clichés en multicolores,
- Mais le « Gold standard » reste le cliché avec un SLO confocal en auto-fluorescence bleue, où l’atrophie apparaît comme une zone hypo-fluorescente, bien délimitée. De plus, l’auto-fluorescence permet de quantifier l’hyper-fluorescence des zones en voie d’atrophie. Cet examen est celui recommandé par le consensus de 2017, présenté à la Macula Society.
- En cas de cataracte, l’image en auto-fluorescence est affectée. Il peut être alors utile de faire des clichés en lumière verte. Moins affectés par l’opacification du cristallin et le pigment maculaire, les clichés en lumière verte permettent une visualisation de la fovéa plus facilement.
- Les appareils SLO ont aussi des images en infrarouge, moins affectées que la lumière bleue par la cataracte, avec une haute réflexivité des zones atrophiques, mais ces lacunes hyper-réflectives sont moins spécifiques.
- Enfin, certaines rétinographies ont une fonction auto fluorescence, mais les limites sont bien plus floues que sur les clichés avec un SLO.
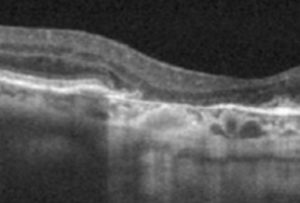
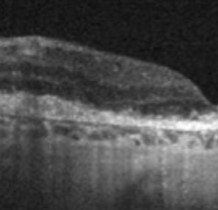
- En OCT, la zone d’atrophie apparaît comme une zone d’hypersignal de la choroïde, par augmentation de la transmission du signal dans la zone où la rétine externe est manquante. Pour mesurer l’aire de l’atrophie, l’OCT en face est très difficile à interpréter. Il faut une autre imagerie dans cette pathologie.
- L’angiographie à la fluorescéine et l’ICG n’ont d’intérêt que pour explorer des néovaisseaux associés.
Pour faire simple, pour affirmer le diagnostic de DMLA atrophique, il faut chez quelqu’un de plus de 50 ans, une association d’aires d’atrophie et de drusen. S’il y a des drusen bleus, nous sommes en présence d’une DMLA.
Sans drusen (ni séreux, ni bleus), pas de DMLA. Les imageries grand champ nous ont permis de voir qu’il y a des zones d’atrophie périphériques en cas d’atrophie centrale.
- S’il y a des taches jaunâtres en flammèche, on est probablement face à une maladie de Stargardt tardive.
- S’il y a une atrophie centrale sans drusen ni taches jaunâtres, il peut s’agir d’une dystrophie choroïdienne aréolaire centrale ou plus fréquemment d’une forme tardive de dystrophie vitelliforme, ou d’une pattern dystrophie (à lésions symétriques).
Dans une étude menée à l’université de Radboud (Nimègue, Pays Bas), Carel Hoyng a retrouvé 5% de cas étiquetés à tort DMLA atrophique. Il s’agissait en fait de maladies génétiques menant à l’atrophie comme un Stargardt. Dans d’autres études, cette proportion arrive même à 10% de cas inclus à tort.
Cela peut certainement altérer la pertinence statistique de l’étude, d’autant que l’évolution de la DMLA atrophique étant lente, il faudrait une étude longue pour percevoir des différences entre les groupes témoins et traités.
Ce qui nous mène à la deuxième question :
Est-ce que les cas inclus ne sont bien que des cas à croissance rapide, chez qui on peut vraiment voir un ralentissement de la progression de l’atrophie ?
S’il s’agit d’un cas à croissance lente (de l’ordre d’1 mm2 par an), il faudrait des années pour voir un effet. Si la croissance est de 5 mm2 par an, on aura plus facilement des différences entre les groupes au bout des 2 ans d’études. La progression moyenne des aires d’atrophie est de 1,1 à 2,8 mm2 par an, selon les études.
Quels sont les facteurs de croissance rapide ?
- Il n’y a pas de lien entre la croissance des aires d’atrophie et l’âge, le sexe et le diabète.
- L’action du tabac est incertaine : aggravant dans certaines études, il est indifférent dans l’autre, et même protecteur dans d’autres études épidémiologiques !
- Génétiquement, une variation du gène ARMS2 est délétère, alors qu’une variation du gène codant pour le facteur 3 du complément est protectrice.
- Enfin, l’atrophie de l’autre œil est un facteur de croissance rapide.
On savait déjà que les hyper-auto-fluorescence péri-lésionnelles étaient signe d’atrophie à croissance rapide. La GAP Study a montré que le type d’atrophie est important : la croissance est plus lente dans les atrophies :
- De petite taille versus moyenne
- Unifocale versus multifocale (plus les bords sont découpés, plus ça va vite)
- Rétro-fovéolaire versus extra-fovéolaire
- La présence de pseudo-drusen est un facteur de risque de croissance rapide
La croissance de l’aire d’atrophie commence doucement puis accélère avec le temps, avec une chute de l’acuité de plus en plus rapide. Elle est plus rapide si l’œil controlatéral est atteint.
Pour l’évaluation de la surface atteinte, l’étude AREDS mesurait l’aire de l’atrophie en diamètre papillaire. Elle doit mesurer au moins 1/4 du diamètre papillaire. Mais depuis 2013, et l’apparition de logiciels de mesure, l’aire de l’atrophie se mesure en mm2. Nous devrions prochainement (probablement à l’AAO) avoir la nouvelle classification des atrophies concoctée par la CAM (Classification Atrophy Meeting).
Pour l’instant, il faut garder en mémoire la classification de l’atrophie basée sur l’OCT concoctée par la CAM et présentée Angiogenesis en 2017. Le CAM s’est concentré sur l’OCT car cette technique permet de suivre le devenir des différentes couches rétiniennes. On distingue :
· cRORA (ou complete RPE and Outer Retinal Atrophy) : atrophie complète de l’épithélium pigmentaire et de la rétine externe
· iRORA (ou incomplete RPE and Outer Retinal Atrophy) : atrophie incomplète de l’épithélium pigmentaire et de la rétine externe
· cORA (ou complete Outer Retinal Atrophy) atrophie complète de la rétine externe, mais avec intégrité de l’épithélium pigmentaire
· iORA (ou incomplete Outer Retinal Atrophy) : atrophie incomplète de la rétine externe : il y a une altération de l’ellipsoïde et un amincissement de la rétine externe. Une partie de l’épithélium pigmentaire ou des photorécepteurs peut persister, mais la zone est vouée à évoluer vers l’atrophie complète.
Le diamètre doit être de 250 μm au minimum pour classer la lésion comme atrophique.
NB : exclusion de tout signe de déchirure de l’épithélium pigmentaire.
Ces abréviations sont régulièrement utilisées dans les communications et les publications. Classer les stades de l’atrophie permet de repérer les stades précoces. Cette classification sera utile lorsque nous aurons un traitement à notre disposition, pour harmoniser les arbres décisionnels.
Ce qui nous amène au 3° volet de cette mise au point sur l’atrophie :
Est-ce qu’on s’est adressé à la bonne cible thérapeutique ?
Après bien des espoirs, finalement les compléments alimentaires (antioxydants) semblent peu efficaces pour prévenir l’évolution des lésions atrophiques déjà constituées.
Il nous reste l’éviction des agressions, que sont la lumière solaire et le tabac (même si l’influence de ce dernier est discuté).
Les traitements qui ciblent le E2E, hautement pro-oxydant, ont trop d’effets secondaires.
Certaines études ont montré que les statines pouvaient accélérer la résorption des drusen. Mais il n’y a pas de preuve formelle de l’efficacité de la régression des drusen en prévention de l’atrophie.
Les inhibiteurs du complément ont été décevants.
L’APL-2, qui régule le facteur 3 du complément semblait efficace dans l’étude Filly (phase 2) avec un ralentissement de la croissance de 20% s’il est injecté tous les 2 mois (p=0,067) et de 28,6% s’il est injecté tous les mois (p=0,008). (Cf le rapport de l’AAO 2018.)
Il s’agit d’un ralentissement de l’évolution des aires d’atrophie et non d’une régression de l’atrophie. Mais c’est mieux que rien.
Deux nouvelles études de phase 3 avec l’APL-2 sont en cours : l’étude Derby et l’étude Oaks dont nous aurons les résultats dans 2 ans.
D’autres études de phase I ou II sont en cours, qu’il s’agisse de neuro protecteur (comme la Brimonidine), ou de thérapie génique. Mais il n’y a pas de résultats positifs pour l’instant.