Les futurs traitements de la DMLA
Une session d’Angiogenesis a été dédiée aux molécules annoncées comme prochainement disponibles. Une autre page est dédiée au Brolucizumab dont nous devrions disposer en fin d’année. Cette page s’intéresse aux molécules qui devraient émerger dans les prochaines années.
Il y a 3 nouveaux anti-VEGF juste autorisés ou en cours de validation aux USA :
- Brolucizumab
- Abicipar
- Combercept
Et un produit à l’action combinée : le Faricimab.
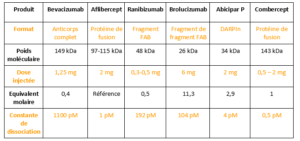
1/ Abicipar Pegol : c’est une DARPIn
Les DARPIn sont de petites molécules qui sont rapidement éliminées. Les mettre sous forme de gel augmente la rémanence (la ½ vie). Le design permet une forte activité : il est très actif à une petite dose.
Les études Cedar et Sequoia d’une durée de 1 an ont été prolongées à 2 ans. Elles comparent une prise en charge des DMLA par Abicipar en Q8 et Q12 versus Ranibizumab en Q4.
Le gain d’acuité visuelle est semblable dans tous les groupes (un peu moins bien pour le q12) avec un maintien de l’acuité visuelle au cours de la 2° année avec seulement 4 IVT dans le groupe Abicipar q12 (10 IVT à 2 ans, versus 25 pour le Ranibizumab).
Anatomiquement, de petites fluctuations de l’épaisseur maculaire centrale lors des contrôles mensuels sans IVT ont été constatés, mais ils sont sans conséquences sur le résultat visuel final.
Le problème, c’est l’inflammation :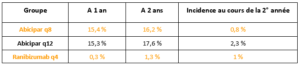
91 % des inflammations apparaissent au début du traitement (au cours des 4 premières IVT).
Les patients tolérants le produit la première année auraient une meilleure tolérance la deuxième année, mais l’incidence des inflammations la deuxième année reste loin d’être négligeable.
Les industriels ont lancé alors l’étude Maple avec un Abicipar 2 mg modifié pour une meilleure tolérance. Le protocole est une dose de charge 3 mois, puis des injections tous les 2 mois jusqu’à la semaine 28. Le résultat n’est pas fameux :
Total inflammation à 6 mois : 8,9 %
- Uvéites : 2,4 %
- Tyndall vitréen : 0,8 %
- « Vitritis » : 1,6 %
- Iridocyclite : 2,4 %
- Iritis : 2,4 %
- Précipités rétro-cornéens : 0,8 %
Dans Maple, malgré la purification de la molécule, il y a :
- 2,4 % inflammation minimes
- 4,9 % d’inflammation modérée
- 1,6 % d’inflammation sévère
A comparer avec les 1 % d’inflammation des autres anti-VEGF…
Mais qu’on se rassure, ces inflammations cèdent avec un traitement par corticothérapie…
2 / Le Faricimab
C’est un anticorps bispécifique : il se lie à la fois au VEGF A et à l’angiopoiétine 2. Il a une activité anti-inflammatoire ET anti-fibrotique. L’angiotensine augmente la perméabilité des parois vasculaires.
Il a une demi-vie de 56 jours dans le vitré (2 fois plus que le Ranibizumab), et une forte affinité pour ses cibles. Les dosages itératifs de VEGF dans l’humeur aqueuse montrent une diminution stable du taux de VEGF pendant 2 mois, comparé à des réapparitions mensuelles de VEGF sous Ranibizumab’ entre chaque injection. Le dosage de l’angiopoiétine 2 montre une diminution stable sur 2 mois, avant une lente remontée. Des études sont en cours pour apprécier l’effet de stabilisation de la membrane vasculaire du Faricimab.
3 études ont été faites avec ce produit : Boulevard (pour le diabète), Avenue et Stairway (pour la DMLA).
Boulevard comparait le Ranibizumab 0,3 mg au Faricimab 1,5 mg et 6 mg dans des cas d’OMD.
A 6 mois, le gain d’acuité visuelle était supérieur de 1,4 lettres pour le 1,5 mg et de 3,6 lettres pour le 6 mg versus le gain obtenu avec le Ranibizumab. Avec une meilleure stabilité à l’issue de l’étude (délai plus long pour la rechute).
L’étude Stairway étudiait des DMLA néovasculaires, avec un schéma d’injection variable, toutes les 12 ou toutes les 16 semaines, sur un critère de baisse d‘acuité visuelle, comparé au Ranibizumab mensuel.
Ont été inclus des DMLA naïves avec des néovaisseaux rétro-fovéolaires, un âge > 50 ans, une acuité visuelle entre 20/320 (24 lettres) et 20/40 (73 lettres).
Le résultat anatomique et fonctionnel des 2 bras sous Faricimab tous les 3 ou 4 mois est similaire au résultat du Ranibizumab mensuel.
65 % des patients n’ont pas de signe d’activité néovasculaire 12 semaines après la dernière injection. C’est donc un produit prometteur.
En cours : les études de phase III : Tenaya et Lucerne, qui vont comparer le Faricimab en Q16 « flex » (je suppose qu’on peut revenir à Q12) à l’Aflibercept Q8.
3/ Le Combercept
Même si cette molécule n’a pas été évoquée en détail à Angiogenesis, les USA vont y avoir accès, et nous pouvons prochainement avoir des études la concernant. Aussi, il peut être utile de la présenter ici.
C’est une « protéine de fusion », comme l’Aflibercept qui se lie aux récepteurs 1 et 2 du VEGF. L’affinité pour le VEGF est très importante.
L’étude Phoenix a montré une augmentation rapide de l’acuité visuelle (+ 9 lettres en 3 mois) puis un plateau (maintien du gain d’AV).
L’étude Panda qui est en cours va comparer l’Aflibercept selon son AMM (3 IVT initiales puis toutes les 8 semaines) avec le Combercept 0,5 mg selon le même protocole d’injections, et le Combercept 1 mg avec un traitement trimestriel (12 S).
Où serons-nous dans 3 ans ?
Le Brolucizumab va commencer à être utilisé en France pour la DMLA. Les études pour l’œdème maculaire diabétique sont en cours.
L’Abicipar est en cours d’évaluation par la FDA.
Le Combercept et le Faricimab ont fini d’inclure leurs études de phase III.
« « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « « «
La vitesse d’association du ligand à son récepteur est égal à la vitesse de dissociation du complexe. La constante de dissociation reflète l’affinité du ligand pour son récepteur. C’est la concentration de ligand qui occupe à l’équilibre 50 % des sites du récepteur. Quand tous les sites sont occupés, la constante de dissociation est de 1 (…ou pas ?).