Angiogenesis 2022
Angiogenesis a été encore virtuel cette année, mais le programme a été chargé, sur deux journées.
Ont été présentés et discutés les résultats d’études de phase III, qui changeront prochainement nos pratiques :
- De nouvelles molécules
- Kite Kestrel et Kingfisher (laboratoire Novartis) pour le Brolucizumab dans l’œdème maculaire diabétique
- Tenaya et Lucerne (Roche/Genentech) pour le Faricimab dans la DMLA néovasculaire
- Yosemit et Rhine (Roche/Genentech) pour le Faricimab dans l’œdème maculaire diabétique, et la rétinopathie diabétique
- Derby et Oaks (Apellis) sur le Pegcetacoplan dans la DMLA atrophique
- D’anciennes molécules présentées différemment
- Candela (Bayer) pour l’Aflibercept (8 mg) dans la DMLA néovasculaire
- Archway (Roche/Genentech) pour le Ranibizumab (en réservoir) dans la DMLA néovasculaire
Des molécules en phase I et II, porteuses d’espoir :
- Pour la DMLA atrophique :
- Un espoir avec un traitement par voie orale qui inhibe la connexin 43 (Xiflam)
- Une thérapie génique : GT005 : production de facteur I du complément
- Pour la DMLA néovasculaire :
- Durasert : un implant de Vorolanib
- OTX-TKI : un implant d’Axinib à libération prolongée
- UBX1325 en IVT contre le vieillissement cellulaire
- GB-102 ou sunitinib, jouant sur les dépôts de maléate
- Des thérapies géniques :
- 4D-150 : deux gènes sur AAV
- RGX-134
- Pour le diabète :
- Le même espoir avec le Xiflam par voie orale qui inhibe la connexin 43
- APX3330 : un traitement par voir orale pour la rétinopathie diabétique
- THR-149 : en IVT
- RGX-314 : une thérapie génique
Nous allons revoir tous ces éléments progressivement.
Pour cette première newsletter :
- Deux noms que nous allons peut-être devoir apprendre : le Xiflam et GT005
- Deux molécules que nous allons peut-être utiliser prochainement dans l’œdème maculaire diabétique : le Brolucizumab et le Faricimab
1/ Inhibition of Connexin43 for the Treatment of AMD and Diabetic Retinopathy
Une cascade inflammatoire inhibée par un comprimé de Xiflam par jour
David S. Boyer
Étude de phase 2
mode d’action
Anti-inflammatoire par voie orale, le Xiflam (InflammX Therapeutics), initialement prévu pour traiter les migraines, passe la barrière hémato-rétinienne.
Dans les cascades inflammatoires impliquées dans la néovascularisation, il y a la mise en jeu d’inflammasomes. Le NLRP3 est un inflammasome qui joue sur une auto-inflammation microvasculaire.
Des canaux cellulaires (Connexin43) s’ouvrent prématurément, avec libération d’ATP dans l’espace extra-cellulaire, ce qui active les inflammasomes via le NLRP3 (NACHT, LRR, and PYD domains-containing protein 3)
Le Xiflam joue sur le NLRP3.
Ce pourrait être une alternative aux injections intravitréennes mensuelles pour la DMLA le diabète, et des pathologies rénales
Testé en laboratoire:
Le Xiflam a été testé avec succès sur des rats diabétiques et des rats présentant une DMLA atrophique. Disparition des micro-anévrysmes dans le premier cas, préservation de la rétine au-delà de 3 mois dans le second cas.
Etudes chez les diabètiques:
Une étude récente* a montré que la réponse au Bevacizumab et à la dexaméthasone était moindre en cas de problèmes rénaux chez les diabétiques : améliorez l’un, et vous pourrez probablement améliorer l’autre
*Hwang H, Lee H, Kim, Jin Y, et al. Systemic factors and early treatment response to intravitreal injection for diabetic macular edema. The role of renal function. Retina 2021;41:1275-1282.
L’étude préliminaire de phase 1 a retrouvé une bonne tolérance.
On inclut en ce moment 130 patients diabétiques dans une étude de phase 2 du DRCRnet, randomisés 1 :1 Xiflam versus placebo, pour un suivi mensuel de 3 mois, et une fin d’étude à 6 mois. Le critère principal est l’épaisseur rétinienne centrale.
Etude sur la DMLA
Une autre étude de phase 2 sur des DMLA atrophiques modérées à sévères est en projet, avec 130 patients qui seront suivis 12 mois, pour évaluer la stabilisation des lésions.
2/ CFI Supplementing Gene Therapy in GA Clinical Trial Update
L’étude Focus : thérapie génique dans la DMLA atrophique visant le facteur I du complément.
Nadia K. Waheed
La présentation de l’étude Focus, étude de phase I/II, et de ses résultats préliminaires, a été faite à Angiogenesis par Nadia K. Waheed. Il s’agit d’une thérapie génique dont le support est un virus : AAV, et qui cible le facteur I du complément, appelé GT005 (de Gyroscope Therapeutics).
Ce virus modifié est injecté en sous-rétinien, et il va produire du facteur I du complément. Ce facteur I est un des inhibiteurs du complément. Le rôle de ce facteur I est de ralentir l’hyperactivité du complément retrouvé dans certaines pathologies, comme la DMLA.
Il y a 3 dosages de GT005 à l’essai, et il y a 2 voies d’injection sous-rétinienne à l’étude : intravitréenne et trans-sclérale.
Les résultats préliminaires montrent une bonne tolérance de la voie trans-sclérale.
En cours d’étude, le taux de facteur I du complément va être mesuré dans le vitré avant et après l’injection de GT005.
Une augmentation prolongée (1 an pour certains patients) du facteur I a été mesurée. L’augmentation persiste à 2 ans pour les quelques patients suivis 2 ans.
D’autre part, il y a aussi une réduction du facteur 3 du complément, montrant l’efficacité de cette augmentation du facteur I.
Surtout, une diminution clinique de l’inflammation chronique a été observée.
En parallèle à cette étude Focus, il y a deux études Horizon et Explore, en cours d’inclusion qui s’intéressera à l’effet de GT005 sur la DMLA atrophique, et en particulier sur la taille de la lésion.
3/Brolucizumab for the Treatment of DME: 100-Week Results from the Two Pivotal Phase III KESTREL and KITE Studies
Les résultats de Kite et Kestrel à 100 semaines : un premier pas vers l’approbation du Brolucizumab dans le diabète par la FDA
Carl Regillo
Ces deux études de phase III comparent le Brolucizumab à l’Aflibercept dans les cas d’œdème maculaire diabétique.
Les résultats à 1 an étaient encourageants, avec une non-infériorité du Brolucizumab sur l’Aflibercept confirmée à 52 semaines. Cette tendance se confirme à 2 ans.
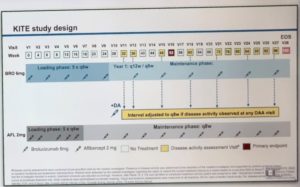
Le schéma des études:
Dans Kestrel
les 2 mg d’Aflibercept sont comparés à deux dosages de Brolucizumab : 3 mg et 6 mg.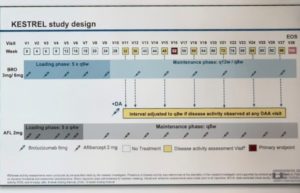
Le Brolucizumab a une phase d’induction particulière de 5 injections toutes les 6 semaines, puis une évaluation, et une phase de maintien avec injections soit toutes les 8 soit toutes les 12 semaines jusqu’à la semaine 100.
Le groupe Aflibercept a une injection mensuelle pendant 5 semaines, puis une injection toutes les 8 semaines jusqu’à la semaine 100.
L’insu est donc impossible, ne serait-ce qu’à cause du rythme différent des injections.
Dans Kite
l’Aflibercept n’est comparé qu’au Brolucizumab 6 mg.
Le groupe Aflibercept a le même biorythme de traitement : induction mensuelle : 5 IVT puis IVT en Q8.
Mais dans le groupe Brolucizumab, qui commence de la même façon que Kestrel (5 IVT toutes les 6 semaines), Kite propose un traitement de type Treat And Extend, avec la possibilité, à partir de la semaine 72, d’étendre l’intervalle de réinjection à 12 voire 16 semaines, selon l’activité de la maladie.
Résultats:
La non-infériorité du Brolucizumab sur l’Aflibercept a été maintenue tout au long de cette deuxième année dans les deux études.
L’acuité visuelle des groupes Brolucizumab est proche de celle du groupe Aflibercept tout au long des deux ans.
La récupération anatomique évaluée par l’épaisseur rétinienne centrale est comparable tout au long des deux études, et ce, avec un nombre d’injections moindre dans le (les) bras Brolucizumab.
Cette tendance est même très nette avec Kite, où la proportion de patients « secs » (défini par une EMC < 280mg) est supérieure dans le groupe Brolucizumab à 1 an et à 2 ans, et ce, malgré l’augmentation possible de l’intervalle lors de la 2° année.
Ceci posé, « en vraie vie » le groupe Aflibercept aurait pu avoir moins d’injections, avec, qui sait, le même résultat visuel et/ou anatomique, mais le design imposait ce nombre de 5 IVT mensuelles puis Q8 sur 95 mois.
Dans Kestrel 1/3 des patients étaient traités toutes les 12 semaines, et dans Kite, près de la moitié des patients ont atteint un intervalle de 12 semaines, 24,8% ont même atteint 16 semaines à la fin des deux ans.
Pour le stade de la rétinopathie, une proportion comparable de patients a gagné 2 stades ETDRS, et a maintenu cette amélioration au cours des deux ans.
Tolérance
Enfin pour la tolérance, les résultats sont proches de ceux retrouvés dans les DMLA. Pour les groupes à 6 mg, il y a eu 4,2% d’inflammation dans Kestrel, et 2,2% dans Kite, comparé à 1,1% des cas d’Aflibercept dans Kestrel et 1,7% dans Kite.
NB : Il n’y a pas eu chez ces patients diabétiques de cas de vascularite, comme on a pu en avoir avec les DMLA, et les quelques cas d’occlusion veineuses observés n’ont pas eu de signes d’inflammation concomitants. Les complications semblent arriver la première année, avec peu de complications au cours de la 2° année de traitement.
Ces résultats devraient permettre au Brolucizumab d’obtenir une validation par la FDA pour le traitement des œdèmes maculaires diabétiques, comme cela a été le cas avec la DMLA.
NB: Le Brolucizumab a été accepté par la commision Européenne en 2020 pour la DMLA. Il vient d’être accepté (début avril 2022) pour l’œdème maculaire diabétique. Pour autant, le remboursement n’est pas encore à l’ordre du jour en France.
4/ Faricimab in DME: 2 Year Data of the Yosemite/Rhine Phase 3 Studies
Un traitement par Faricimab, efficace et bien toléré à 2 ans pour l’OMD
John A. Wells
Les résultats de Yosemite et Rhine à 1 an ont été maintenus à 2 ans, avec des intervalles d’injections allant jusqu’à 16 semaines chez un grand pourcentage de patients.
Yosemite (940 patients) et Rhine (951 patients) sont deux études de phase III comparant le Faricimab (Anticorps bispécifique qui bloque le VEGF A et l’Angiopoïetine 2) à l’Aflibercept.
Les résultats à 1 an (moyenné entre les visites à 48, 52 et 56 semaines) avaient montré la non infériorité du Faricimab sur l’Aflibercept, tant sur le plan visuel qu’anatomique, avec un moindre nombre d’injections. Les résultats à 2 ans ont été présentés à Angiogenesis 2022.
Le schéma des études:
Dans ces études, les patients étaient randomisés en 2 bras Faricimab, ou 1 bras Aflibercept.
- Dose de charge de 6 IVT toutes les 4 semaines de Faricimab 6 mg suivi d’IVT toutes les 8 semaines
- Soit 4 IVT à Q4 de Faricimab 6 mg suivi d’une prise en charge de type Treat And Extend, avec des critères de retraitement sur la meilleure AV corrigée (MAVC) et l’épaisseur rétinienne centrale (ERC).
- Comparé à Aflibercept 2 mg toutes le 4 semaines pendant 5 IVT suivi d’injections toutes les 8 semaines.
Pour le TAE, les injections étaient continuées toutes les 4 semaines jusqu’à une ERC < 325 µm. Lorsque l’ERC était stable, l’intervalle était augmenté de 4 semaines, tant que la MAVC restait stable.
En cas d’aggravation, le traitement était intensifié.
Les résultats:
Les 3 groupes ont gagné 10 à 11 lettres à 1 an. Ces résultats ont été maintenus à 2 ans. Les deux groupes de Faricimab sont non-inférieurs à l’Aflibercept.
A 1 an, 50% des patients en TAE avaient atteint un intervalle de 16 semaines, 20% un intervalle de 12 semaines. Seul 7% des patients de ce groupe ont nécessité de rester en Q4 sur toute l’année.
A 2 ans, 60% à 65 % des patients en TAE avaient atteint un intervalle de 16 semaines, 80% à un intervalle d’au moins 12 semaines. Seul 7% des patients de ce groupe ont nécessité de rester en Q4 sur toute l’année. La plupart des patients en Q16 ou Q12 la première année ont maintenu cet intervalle la 2° année.
Les patients en TAE ont reçu une médiane de 3 IVT la 2° année, comparé aux 5 IVT des eux autres bras des études.
Un gain de vision ≥ 3 lignes a été comparable dans les 3 groupes au cours des 2 ans.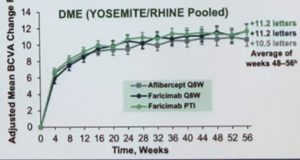
La baisse d’ERC a été importante et stable dans le temps dans tous les bras à 1 an. La réduction d’épaisseur centrale sous Faricimab a été plus importante et plus rapide que sous Aflibercept à 1 an, mais la différence s’est amenuisée à 2 ans.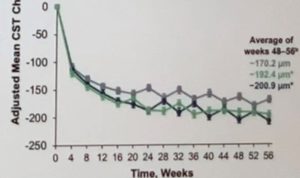
Moins de patients sous Faricimab avaient encore du fluide à 2 ans (absence d’OMD définie comme ERC < 325 µm).
Dans le groupe traité par Faricimab toutes les 8 semaines, l’amélioration du stade ETDRS était plus importante que dans les 2 autres groupes (limite de significativité).
Pas d’effet secondaire oculaire ou systémique sous Faricimab, le nombre d’évènements indésirable, en particulier inflammatoire, était semblable entre les 3 groupes. Il n’y a pas eu de cas de rétinite.
Une étude d’extension (Rhone) est en cours.
A la suite de ces résultats, le Faricimab a reçu un avis favorable de la FDA pour l’œdème maculaire diabétique, mais aussi pour la DMLA, suite aux résultats positifs des études Tenaya et Lucerne.
Il va pouvoir être utilisé aux USA, et nous devrions pouvoir avoir des résultats de « braie vie » à partir de l’année prochaine. De belles communications en perspective !