FDA

News
Newsletter ARMD #4 > septembre 2023
Rencontre avec le Pr Bahram Bodaghi, décryptage de sujets brulants (déconventionnement, financiarisation, retraites, convention médicale...) avec Thierry Bour, président du SNOF, autorisation de commercialisation pour YESAFILI de Biocon Biologics, un deuxième traitement pour la DMLA atrophique accepté par la FDA cet été, l'agenda de la rentrée. ...

Newsletter ARMD #3 > après l’été…
Aflibercept 8 mg validé par la FDA, étude Cochrane sur l'inefficacité des filtres pour la lumière bleue, question sur les occlusions veineuses rétiniennes, pollution atmosphérique et risque de glaucome, agenda... découvrez l'actualité de la rétine et plus encore en lisant la nouvelle newsletter publiée par ARMD. Découvrez la newsletter d'A ...
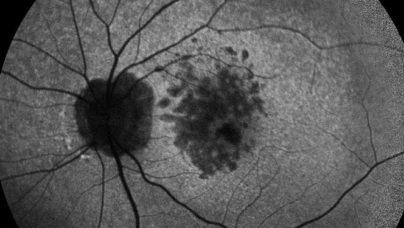
Un deuxième traitement pour la DMLA atrophique accepté par la FDA cet été
En février, le premier traitement pour la DMLA atrophique (le Pegcetacoplan ou Syfovre ®) était accepté par la FDA. Le 4 août en fin de journée un deuxième traitement (Avancicaptad Pegol ou Izervay ®) était accepté à son tour par la FDA. Il devrait être disponible aux USA début septembre. Quelques jours plus tard, l’Avancicaptad pegol ...

La FDA valide l’utilisation de l’Aflibercept HD (8 mg) pour le traitement de la DMLA néovasculaire, la rétinopathie et l’œdème maculaire diabétique (OMD)
Un communiqué de presse de Regeneron a annoncé mi-août que la FDA a validé l’Aflibercept 8 mg grâce aux résultats des études Pulsar et Photon qui démontrent une équivalence d’efficacité de Aflibercept 8 mg et 2 mg, mais avec moins d’injections pour le 8 mg. Une demande de validation a été déposée dans la foulée en Europe et au Japo ...

FDA et Aflibercept
La FDA reporte la validation de l’Aflibercept 8
Par le Dr Isabelle Aknin, ophtalmologiste, présidente d’ARMD Regeneron Pharmaceuticals a annoncé que la FDA a reporté la validation de l’Aflibercept 8 mg. Elle s’en explique dans une lettre (CRL : Complete Response Letter, consultatble en fin d'article) : “FDA issues complete response letter for aflibercept 8 mg biologics license applicati ...
